در این فیلم آموزشی، به مبحث سرعت متوسط واکنش و چگونگی محاسبه آن پرداخته شده است.
سرعت متوسط واکنش چیست؟
به مقدار تولید شده از یک فرآورده یا مقدار ناپدید شده از یک واکنش دهنده تقسیم بر زمان انجام واکنش، سرعت متوسط واکنش گویند. چون تغییرات فرآورده مثبت است، از قدر مطلق بیرون آمده و علامت منفی نخواسته ولی واکنش دهنده چون دارای تغییرات منفی است، وقتی از قدر مطلق بیرون میاید حتما نیاز به استفاده از علامت منفی می باشد.
رابطه محاسبه سرعت متوسط به صورت زیر است:

در رابطه بالا، اگر A واکنش دهنده باشد طبق نکته ذکر شده، رابطه به صورت زیر نوشته خواهد شد.
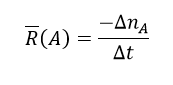
در رابطه بالا، اگر A واکنش دهنده باشد طبق نکته ذکر شده، رابطه به صورت زیر نوشته خواهد شد.
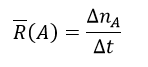
برای فهم بهتر سرعت متوسط به مثال و تست زیر توجه کنید.
مثال: 2 مول A را در یک سامانه وارد می کنیم تا تجزیه شود. پس از 30 ثانیه مقدار آن به 0/2 مول می رسد. سرعت متوسط مصرف A چند mol.s-1 است؟
در این مثال A واکنش دهنده است. قدر مطلق تغییرات واکنش دهنده از طریق رابطه زیر به دست می آید.
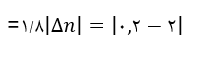
حال برای محاسبه سرعت متوسط خواهیم داشت:

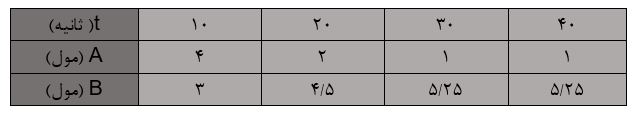
تست: با توجه به جدول زیر، به ترتیب از راست به چپ سرعت متوسط تولید B چند مول بر ثانیه و مقدار اولیه A چند مول است؟
- 0/075 – 4
- 0/075 – 8
- 0/175 – 4
- 0/175 – 8
گزینه 4 پاسخ صحیح می باشد. به منظور یادگیری علت پاسخ صحیح می توانید ویدئو آموزشی را مشاهده کنید.
سرعت متوسط واکنش، برابر است با مقدار تولید شده از یک فرآورده یا مقدار ناپدید شده از یک فرآورده تقسیم بر زمان انجام واکنش.
به منظور آشنایی بیشتر با موضوع سرعت متوسط واکنش و نحوه محاسبه آن می توانید فیلم آموزشی را مشاهده کنید.
سوالات متداول
با محاسبه مقدار تولید شده از یک فرآورده یا مقدار ناپدید شده از یک واکنش دهنده تقسیم بر زمان انجام واکنش، سرعت متوسط به دست خواهد آمد.
برای محاسبه سرعت متوسط باید تغییرات مقدار واکنش دهنده یا فرآورده را بر تغییرات زمان تقسیم نمائیم.
برای محاسبه سرعت متوسط در شیمی از واحد مول بر ثانیه استفاده خواهد شد.





