در این فیلم آموزشی با مبحث استوکیومتری فرمولی ترکیبات و عدد آووگادرو آشنا خواهیم شد. با آموزش موارد ذکر شده قادر به حل نمونه تست های کنکور سراسری خواهید بود.
عدد آووگادرو
در استوکیومتری فرمولی ترکیبیات از عددی به نام عدد آووگادرو استفاده میشود. عدد آووگادرو یا ثابت آووگادرو یک پارامتر ثابت است که تعداد اجزای تشکیل دهنده ماده مثل مولکول ها، اتم ها و یون ها را به مقدار ماده مرتبط می سازد. نام این عدد با توجه نام دانشمند ایتالیایی آمادئو آووگادرو و به پاس تلاش های او انتخاب گردید. مقدار دقیق این عدد برابر با ۱۰۲۳×۶٫۰۲۲۱۴۰۷۶ می باشد.
با استفاده از عدد آووگادرو تعداد اجزای تشکیل دهنده ماده به مقدار ماده مشخص میشود.
استوکیومتری فرمولی ترکیبات
برای محاسبه مول در ترکیبات میتوانیم از دو روش استفاده کنیم. در روش نخست با استفاده از تعداد ذرات و عدد آووگادرو مول را محاسبه میکنیم. رابطه آن مطابق زیر است.
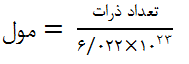
ضمنا برای محاسبه مول در ترکیبات میتوانیم از تقسیم جرم بر جرم مولی نیز استفاده می کنیم. بر این اساس به رابطه زیر خواهیم رسید:
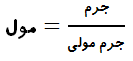
در استوکیومتری فرمولی برای ترکیبات، به منظور محاسبه مول از تقسیم جرم بر جرم مولی استفاده می شود.
مثال
تست: تعداد اتم ها در 2/7 گرم آب، برابر با تعداد اتمها در چند گرم متان است؟ (H2O=18 , CH4=16 g.mol-1)
1) 1/6
2) 3/2
3) 0/48
4) 1/44
گزینه 4 پاسخ صحیح می باشد. برای دسترسی پاسخ تشریحی این سوال ویدئوی آموزشی را مشاهده نمایید.
به منظور آشنایی بیشتر با عدد آووگادرو، استوکیومتری فرمولی برای ترکیبات و نکات آن می توانید فیلم آموزشی را مشاهده کنید.
سوالات متداول
عدد آووگادرو یا ثابت آووگادرو یک پارامتر ثابت است که تعداد اجزای تشکیل دهنده ماده مثل مولکول ها، اتم ها و یون ها را به مقدار ماده مرتبط می سازد. مقدار دقیق این عدد که به نام دانشمند ایتالیایی با همین نام، نامگذاری شده برابر با ۱۰۲۳×۶٫۰۲۲۱۴۰۷۶ می باشد.
برای محاسبه مول در استوکیومتری مولکولی دو شیوه وجود دارد. می توان از تقسیم جرم بر جرم مولی یا تقسیم ذرات سازنده بر عدد آووگادرو استفاده کرد.
ظرفیت عناصر در گروه نخست جدول تناوبی، یک می باشد.






